Why, when and how to start treating PPF* with OFEV®
OFEV is indicated in adults for the treatment of idiopathic pulmonary fibrosis (IPF). OFEV is also indicated in adults for the treatment of other chronic fibrosing interstitial lung diseases (ILDs) with a progressive phenotype. OFEV is indicated in adults for the treatment of systemic sclerosis associated interstitial lung disease (SSc-ILD).1
* PPF = Progressive Pulmonary Fibrosis. In this material PPF refers to progressive, fibrosing lung diseases excluding IPF. The term PPF is used when referring to INBUILD results and the ATS/ERS/JRS/ALAT Clinical Practice guideline (2022) due to overlap in their criteria for progression and comparable clinical outcomes in PPF and PF-ILD.2

Why to treat PPF with OFEV
OFEV reduce lung function decline.1,3
OFEV slows down the annual rate of decline in FVC by 57% in PPF1,3
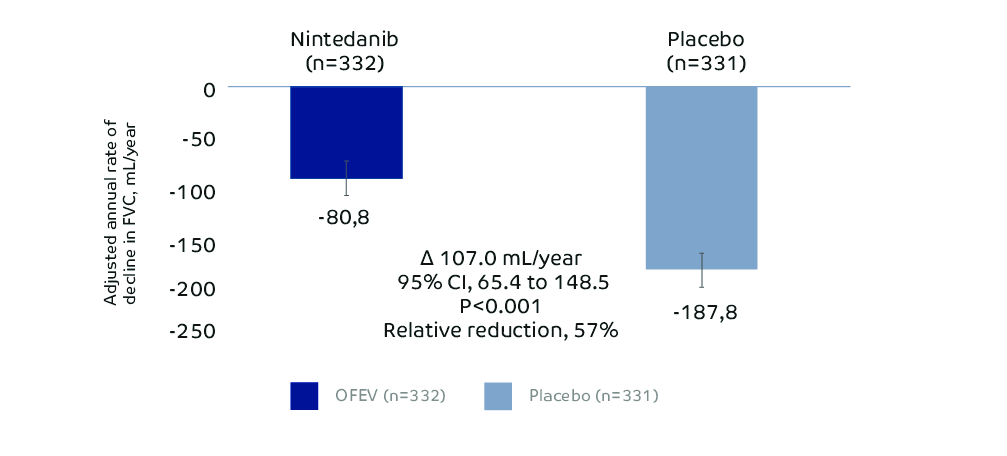
This figure is adapted from Flaherty KR, Wells AU, Cottin V et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N Engl J Med 2019, 381:1718-1727. Supplementary Material
Study design: 663 patients randomized 1:1 to receive either OFEV or placebo over 52 weeks. Randomization was stratified by HRCT pattern (63% UIP-like fibrotic pattern; 38% other fibrotic pattern) based on central review. Part A was conducted during 52 weeks, Part B was a variable treatment period beyond 52 weeks, which was still conducted in a double blind setting until all patients completed Part A.1,3 The primary end point in INBUILD was the annual rate of decline in FVC, assessed over the 52-week period. The main secondary endpoints were absolute change in K-BILD at week 52, time until first exacerbation or death over the 52-week period and time until death over the 52-week period.3 Inclusion criteria, INBUILD: Patients met specific criteria for progression of ILD despite management in the 24 months before screening. >10% extent on HRCT, FVC ≥45% predicted, DLCO ≥30%-<80% predicted.3
REDUCE the risk of acute exacerbations with OFEV1,3

INBUILD: Time to first acute exacerbation of ILD or death in overall population over whole trial.1,3 Hazard ration = 0.37, 95%
CI= 0.46, 0.98. Nominal P=0,04 Study design: 663 patients randomized 1:1 to receive either OFEV or placebo over 52 weeks. Randomization was stratified by HRCT pattern (63% UIP-like fibrotic pattern; 38% other fibrotic pattern) based on central review. Part A was conducted during 52 weeks, Part B was a variable treatment period beyond 52 weeks, which was still conducted in a double blind setting until all patients completed Part A.1,3 The primary end point in INBUILD was the annual rate of decline in FVC, assessed over the 52-week period.
The main secondary endpoints were absolute change in K-BILD at week 52, time until first exacerbation or death over the 52-week period and time until death over the 52-week period.3
PPF = Progressive Pulmonary Fibrosis.
When to treat PPF with OFEV
SUPPORT your PPF patient’s quality of life1,4
OFEV significantly reduced the worsening of cough* and dyspnea in patients with PPF.1,4
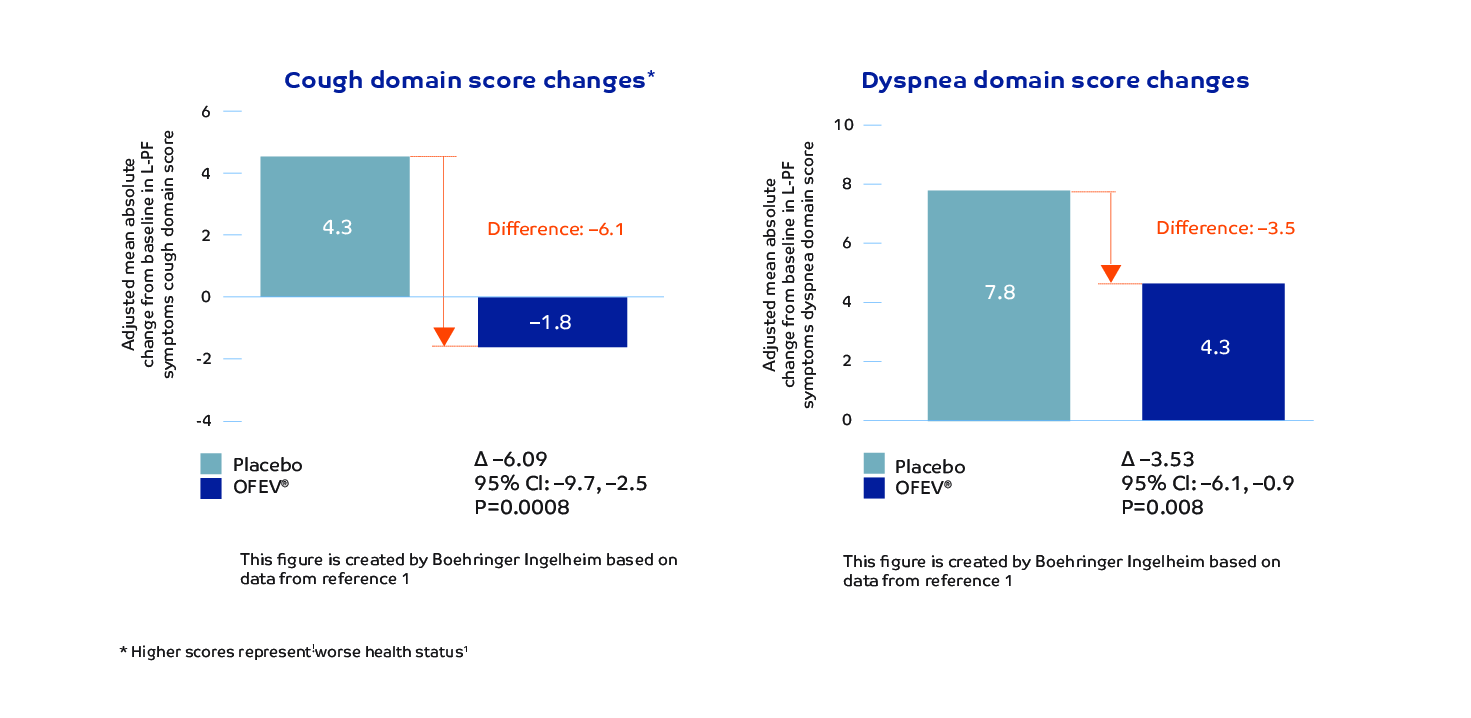
Results based on the Living with Pulmonary Fibrosis (L-PF) questionnaire assesses symptoms and quality of life in patients with fibrosing interstitial lung diseases (ILDs). Higher scores represent worse health status.5
*Cough domain scores meet the threshold for the smallest, clinically significant difference (MCID).4
Criteria for ILD progression1,3
Patients were required to meet ≥1 of the following criteria for ILD progression in the 24 months before screening, despite management:

Consider treatment
Treat according to approved indication and defined progression criteria and guidelines.1,3,8,11
Even if the patients use concomitant immunomodulatory therapy.1,6,7
How to treat PPF with OFEV

The most common AE was diarrhea1 66,9% of patients experienced diarrhea while treated with OFEV making diarrhea the most common side effect of OFEV (INBUILD)1
Dose modification with OFEV allows for the management of some adverse events while supporting continued clinical benefit.1,9
If your patient is reporting adverse reactions, consider:
Temporary treatment interruption or dose reduction to 100 mg twice daily.1
Once the event has resolved, reinstate to the optimal dose of 150 mg twice daily for higher clinical efficacy, as shown in the TOMORROW trial.1,9,10
If your patient is experiencing diarrhea, treat immediately with adequate hydration and initiate anti-diarrheal drugs, such as loperamide.1 Loperamide can be initiated at a dose of 2 mg once daily but if symptoms persist, the dose can be increased up to 4 mg four times daily.9
Ofev® (nintedanib)
Pligttekst:
Indikation: Ofev er indiceret til behandling af idiopatisk lungefibrose (IPF) hos voksne. Ofev er også indiceret til behandling af andre kroniske fibroserende interstitielle lungesygdomme (ILS) med en progressiv fænotype hos voksne. Ofev er indiceret til behandling af systemisk sklerodermi-associeret interstitiel lungesygdom (SSc-ILS) hos voksne.
Kontraindikationer: Graviditet, overfølsomhed over for det aktive stof, jordnødder, soja eller et eller flere af hjælpestofferne.
Bivirkninger*: IPF: Meget almindelige (over 10 %): Diarré (rapporteret hos 62,4 %, hvoraf 3,3 % havde svær diarré), kvalme, abdominalsmerter og forhøjede leverenzymer. Almindelige (1-10 %): Vægttab, nedsat appetit, blødning, opkastning, udslæt og hovedpine. Ikke almindelige (0,1-1%) bivirkninger herunder myokardieinfarkt, proteinuri og leverskade forårsaget af lægemidlet samt bivirkninger med ikke kendt hyppighed herunder aneurismer og arterielle dissektioner, nyresvigt samt posteriort reversibelt encefalopatisyndrom er anført i det fulde produktresumé. PF-ILS: Meget almindelige (over 10 %): Diarré (rapporteret hos 66,9 % hvoraf intensiteten var alvorlig hos 2,4 %), nedsat appetit, kvalme, opkastning, abdominalsmerter, forhøjede leverenzymer. Almindelige (1-10 %): Vægttab, blødning, hypertension, leverskade forårsaget af lægemidlet, udslæt og hovedpine. Ikke almindelige (0,1-1 %) bivirkninger herunder myokardieinfarkt, proteinuri og nyresvigt samt bivirkninger med ikke kendt hyppighed herunder aneurismer og arterielle dissektioner samt posteriort reversibelt encefalopatisyndrom er anført i det fulde produktresumé. SSc-ILS: Meget almindelige (over 10 %): Diarré (rapporteret hos 75,7 %, hvoraf 4,2 % havde svær diarré), kvalme, opkastning, abdominalsmerter og forhøjede leverenzymer. Almindelige (1-10 %): Vægttab, nedsat appetit, blødning, hypertension, og hovedpine. Ikke almindelige (0,1-1 %) bivirkninger herunder leverskade forårsaget af lægemidlet og nyresvigt samt bivirkninger med ikke kendt hyppighed herunder myokardieinfarkt, aneurismer og arterielle dissektioner, proteinuri samt posteriort reversibelt encefalopatisyndrom er anført i det fulde produktresumé.
Særlige advarsler og forsigtighedsregler*: Diarré: Tilfælde af diarré har ført til dehydrering og elektrolytforstyrrelser. Ved første tegn på diarré iværksættes behandling i form af tilstrækkelig hydrering og lægemidler mod diarré, f.eks. loperamid. Afbrydelse, dosisreduktion eller seponering af behandlingen med Ofev kan være nødvendig. Behandlingen kan genoptages med en reduceret eller fuld dosis. Kvalme og opkastning: Oftest let til moderat intensitet, førte til seponering hos op til hhv. 2,1 % og 1,4 %. Understøttende behandling, dosisreduktion eller seponering af behandlingen kan være nødvendig. Leverfunktion: Eksponeringen øges hos patienter med nedsat leverfunktion og dette kan øge risikoen for bivirkninger. Patienter med let nedsat leverfunktion (Child Pugh A) bør behandles med nedsat dosis. Ofev anbefales ikke til patienter med moderat eller svært nedsat leverfunktion pga. manglende erfaring. Der er observeret tilfælde af lægemiddelinduceret leverskade under behandling med nintedanib, herunder svær leverskade med dødelig udgang. Hovedparten af leverhændelserne opstår i løbet af de første 3 måneder. Patienter med en lav legemsvægt (< 65 kg), samt asiatiske og kvindelige patienter har en større risiko for forhøjelser af leverenzymer. Eksponeringen for nintedanib steg lineært med patienternes alder, hvilket også kan medføre en øget risiko for udviklingen af forhøjede leverenzymer Nyrefunktion: Der er rapporteret om tilfælde med nedsat nyrefunktion/-svigt, hvoraf nogle havde dødelig udgang, under behandling med nintedanib. Der er desuden indberettet meget få tilfælde af nefrotisk albuminuri med eller uden nedsat nyrefunktion. Patienter bør overvåges under behandlingen med nintedanib med særlig opmærksomhed på patienter med risikofaktorer for nedsat nyrefunktion/-svigt, og justering af behandlingen bør overvejes. Ved symptomer på nefrotisk syndrom, bør afbrydelse af behandlingen overvejes. VEGFhæmmere er blevet forbundet med trombotisk mikroangiopati (TMA), inklusive indberetning af meget få tilfælde for nintedanib. Hvis laboratorie- eller kliniske fund associeret med TMA forekommer hos en patient, der modtager nintedanib, skal behandling med nintedanib seponeres og en grundig evaluering for TMA skal gennemføres. Blødning, gastrointestinal perforation, iskæmisk colitis og arterielle tromboemboliske hændelser: Vaskulær endotelial vækstfaktor-receptorhæmning (VEGFR-hæmning) kan være forbundet med en øget risiko for blødning. Patienter med kendt risiko for blødning var ikke inkluderet i de kliniske studier. Der skal udvises særlig forsigtighed ved patienter, der har undergået abdominalkirurgi, hvis anamnese omfatter ulcus pepticum, diverticulosis coli eller som samtidigt modtager kortikosteroider eller NSAIDs. Forsigtighed bør udvises hos patienter med øget blødningsrisiko (behandling med koagulationshæmmende lægemidler eller andre lægemidler, der kan forårsage blødning) samt patienter med øget kardiovaskulær risiko. Aneurismer og arterielle dissektioner: Brug af VEGF-hæmmere hos patienter kan fremme dannelse af aneurismer og/eller arterielle dissektioner, hvorfor risikofaktorer bør overvejes inden behandling opstartes. Posteriort reversibelt encefalopatisyndrom (PRES): Der er rapporteret tilfælde af PRES efter markedsføring. PRES er en neurologisk lidelse (bekræftes vha. MR-scanning), som kan vise sig ved hovedpine, hypertension, synsforstyrrelser, krampeanfald, letargi, forvirring og andre visuelle og neurologiske forstyrrelser, og det kan være dødeligt. Ved mistanke om PRES seponeres behandlingen. Genoptagelse af behandling bør kun ske efter lægens anbefaling. Pulmonal hypertension: Data for anvendelsen af Ofev hos patienter med pulmonal hypertension er begrænset. Patienter med signifikant pulmonal hypertension bør ikke behandles med Ofev. Der anbefales nøje overvågning af patienter med let til moderat pulmonal hypertension. Administration sammen med pirfenidon: Benefit-risk-forholdet for samtidig behandling med pirfenidon er ikke klarlagt.
Interaktioner*: Potente Pgp-hæmmere (f.eks. ketoconazol, erythromycin og ciclosporin) kan øge eksponeringen for Ofev. Patienterne skal kontrolleres tæt, og håndtering af bivirkninger kan kræve behandlingsafbrydelse, dosisreduktion eller seponering af Ofev. Potente P-gp-induktorer (f.eks. rifampicin, carbamazepin, phenytoin og perikon) kan reducere eksponeringen for Ofev.
Fertilitet, graviditet og amning*: Fertile kvinder i behandling med Ofev skal undgå graviditet. Amning skal ophøre. Prækliniske dyrestudier har påvist reproduktionstoksisitet.
Trafikfarlighed*: Ofev påvirker i mindre grad evnen til at føre motorkøretøj og betjene maskiner. Patienterne skal rådes til at udvise forsigtighed.
Dosering*: Voksne: Den anbefalede dosis er 150 mg Ofev to gange dagligt med ca. 12 timers mellemrum. En dosis på 100 mg to gange dagligt anbefales udelukkende til patienter, der ikke tolererer en dosis på 150 mg to gange dagligt. Ud over symptomatisk behandling kan bivirkninger håndteres ved dosisreduktion eller midlertidig seponering, indtil den specifikke bivirkning er bedret til et niveau, der tillader fortsættelse af behandlingen. Behandlingen kan genoptages med fuld (150 mg to gange dagligt hos voksne patienter) eller reduceret dosis (100 mg to gange dagligt hos voksne patienter). Hvis patienten ikke tåler 100 mg to gange dagligt, bør Ofev seponeres. Må ikke anvendes til børn og unge under 18 år.
Lægemiddelform: Blød kapsel (kapsel).
Pakninger og priser: 100 mg: 60 kapsler, 150 mg: 60 kapsler. Dagsaktuel pris findes på www.medicinpriser.dk.
Udlevering: Begrænset til sygehuse.
Registreringsindehaver: Boehringer Ingelheim International GmbH.
De med * markerede afsnit er omskrevet og/eller forkortet i forhold til det godkendte produktresumé. Yderligere information findes i produktresuméet (www.produktresume.dk), som vederlagsfrit kan rekvireres hos Boehringer Ingelheim Danmark A/S (ansvarlig for markedsføring i Danmark), Weidekampsgade 14, 2300 København S, tlf.: 39 15 88 88, eller via info.cop@boehringer-ingelheim.com. BIDK: v12
References:
-
OFEV® summary of product characteristics. 4th of July 2024.
-
Khor YH, Farooqi M, Hambly N, Kolb M, Ryerson CJ; Austin ILD Registry and CARE-PF Investigators. Patient Characteristics and Survival for Progressive Pulmonary Fibrosis Using Different Definitions. Am J Respir Crit Care Med. 2023;207(1):102-105. doi:10.1164/rccm.202205-0910LE.
-
Flaherty KR, Wells AU, Cottin V, et al. Nintedanib in progressive interstitial lung diseases: data from the whole INBUILD trial. Eur Respir J 2022; 59: 2004538. DOI: 10.1183/ 13993003.04538- 2020.
-
Swigris JJ, et al. Responsiveness and meaningful change thresholds of the Living with Pulmonary Fibrosis (L-PF) questionnaire Dyspnoea and Cough scores in patients with progressive fibrosing interstitial lung diseases. BMJ Open Resp Res 2022;9:e001167. doi:10.1136/ bmjresp-2021-001167.
-
Swigris JJ, Cutts K, Male N et al. The living with pulmonary fibrosis questionnaire in progressive fibrosing interstitial lung disease. ERJ Open Res 2021:00145-2020.
-
Varone F et al. Progressive fibrosing interstitial lung disease: a proposed integrated algorithm for management. Ann Am Thorac Soc 2020;17:1199–203.
-
Cottin, V., Richeldi, L., Rosas, I. et al. Nintedanib and immunomodulatory therapies in progressive fibrosing interstitial lung diseases. Respir Res 22, 84 (2021). doi: 10.1186/s12931-021-01668-1.
-
Raghu G et al. Idiopathic Pulmonary Fibrosis (an Update) and Progressive Pulmonary Fibrosis in Adults. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med 2022;205:e18–e47.
-
Bendstrup E. et al. Nintedanib in Idiopathic Pulmonary Fibrosis: Practical Management Recommendations for Potential Adverse Events. Respiration 2019;97:173-184. doi: 10.1159/000495046
-
Richeldi L, Costabel U, Selman M, et al. Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. N Engl J Med. 2011; 365(12): 1079-1087.
-
Davidsen JR, Shaker S, Lund TK, Huremovic J, Gjørup J, Bendstrup E. Progressiv Fibrotisk Interstitiel Lungesygdom (PF-ILS) www.lungemedicin.dk Dansk Lungemedicinsk Selskab; 2022 May 1. Available from: Progressiv Fibrotisk -ILS (PF-ILS)-DLS.
